Sumário do Curso

Rastreamento, check-up, e prevenção quaternária
- Introdução: o que são os rastreamentos e seus tipos
- Rastreamento e prevenção: relacionando classificações e conceitos
- Importância da P4 na recomendação dos rastreamentos
- Considerações finais: síntese para a abordagem dos rastreamentos na APS
- Resumo da unidade

Recomendações sobre rastreamento em adultos e idosos
- ‘Doutor, quero fazer um check-up’
- Rastreamento de condições crônicas do estilo de vida
- Rastreamento e prevenção do câncer
- Rastreamento de Infecções Sexualmente Transmissíveis (ISTs)
- Rastreios não recomendados
- O rastreamento no idoso
- O rastreamento em mulheres
- O rastreamento em homens
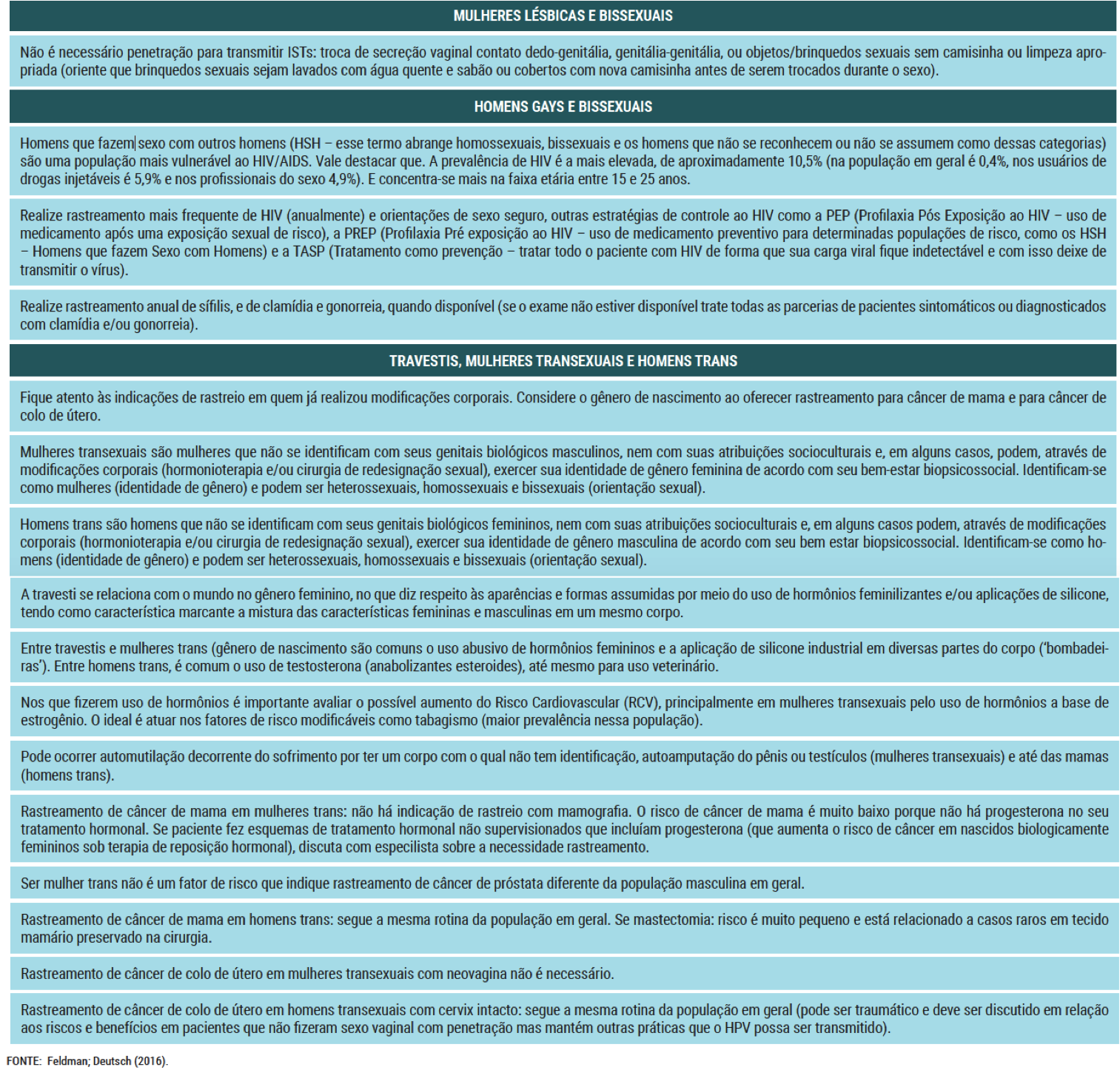
- O rastreamento em Lésbicas, Gays, Bissexuais, Travestis e Transexuais (LGBT)
- Resumo da unidade

Recomendações sobre rastreamento na criança
- Programa Nacional de Triagem Neonatal (PNTN)
- Triagem Auditiva
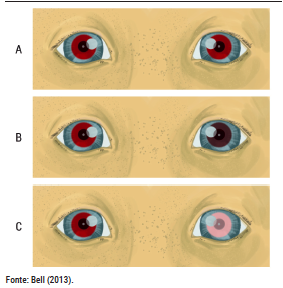
- Triagem Visual
- Outras avaliações por exames complementares
- Outras avaliações por exame físico
- Importância do olhar integral
- Resumo da unidade

A prática do rastreamento e a organização do processo de trabalho na Atenção Primária
- Atenção primária à saúde: equilíbrio entre ações preventivas e curativas
- Saúde e seu paradoxo
- Abordagem centrada na pessoa, prevenção quaternária, e medicalização
- Gestão da clínica: acolhimento, acesso avançado e organização da agenda
- Resumo da unidade
Carta dos Autores
Caro aluno, seja bem-vindo!Este módulo apresenta e discute aspectos essenciais dos rastreamentos ou screenings, também conhecidos como check-ups, uma forma de prevenção cada vez mais utilizada na Atenção Primária à Saúde (APS). Além disso, você irá conhecer as melhores evidências e práticas para recomendar (e também deixar de recomendar) rastreamentos para seus pacientes adultos e crianças nas mais variadas situações, assim como refletir sobre a organização do processo de trabalho para melhor atender essas demandas.
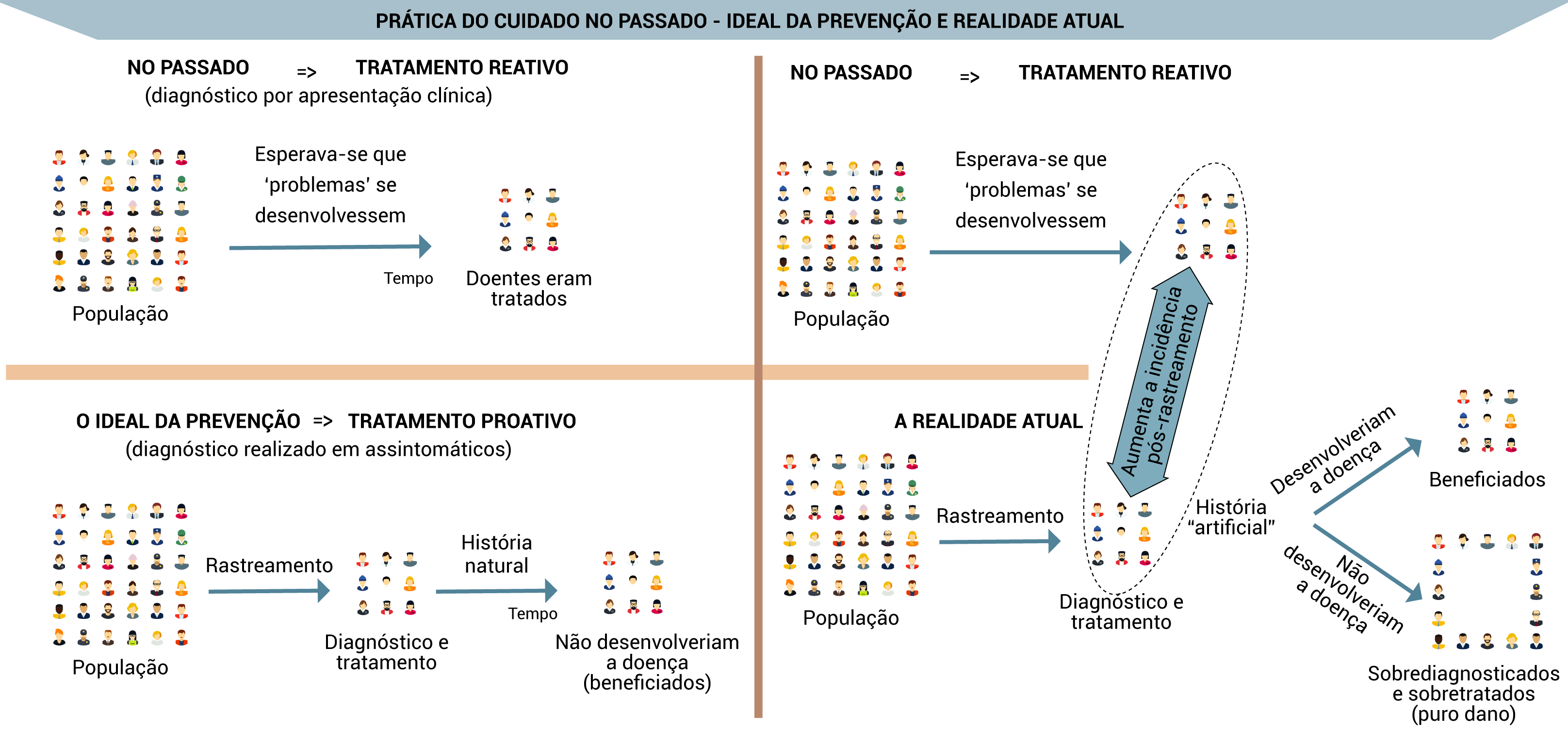
A existência de algumas diretrizes oficiais que mencionam a prevenção como prioritária na APS tende a construir uma cultura acrítica que supervaloriza ações e cuidados preventivos. Entretanto, neste módulo você vai entender que os rastreamentos são uma forma particularmente problemática e complexa de ação preventiva que exige muito cuidado na sua recomendação, tanto por parte dos gestores do sistema como dos profissionais da APS.
Embora os rastreamentos tenham o potencial de produzir benefícios às pessoas e à coletividade - e pareçam ser simples de implementar, devido ao aspecto protocolar de suas recomendações - a maioria deles tende a produzir danos. Entender esses danos, muitos deles difíceis de serem reconhecidos pelos usuários e por você profissional de saúde, é um pré-requisito para que se possa evitar ao máximo situações e práticas que facilitam sua ocorrência. Isso requer uma mudança de atitude para a prática da prevenção quaternária (P4), que tem por objetivo evitar o excesso de intervenções que podem causar mais mal do que bem. A P4 é muito importante no caso do manejo das recomendações e das demandas por rastreamentos.
Esperamos que você possa usufruir deste módulo, aprimorar a sua prática profissional e adquirir mais clareza, segurança e competência para manejar as situações e pressões cada vez mais frequentes na APS em que ações preventivas, e particularmente os rastreamentos, estão envolvidos.
Professores: Ronaldo Zonta, Armando Henrique Norman, Charles Dalcanale Tesser, Marina P. Galhardi e Nuno de Mattos Capeletti
Unidade 1 - Sumário
1 Rastreamento, check-up, e prevenção quaternária
1.1 Introdução: o que são os rastreamentos e seus tipos
1.2 Rastreamento e prevenção: relacionando classificações e conceitos
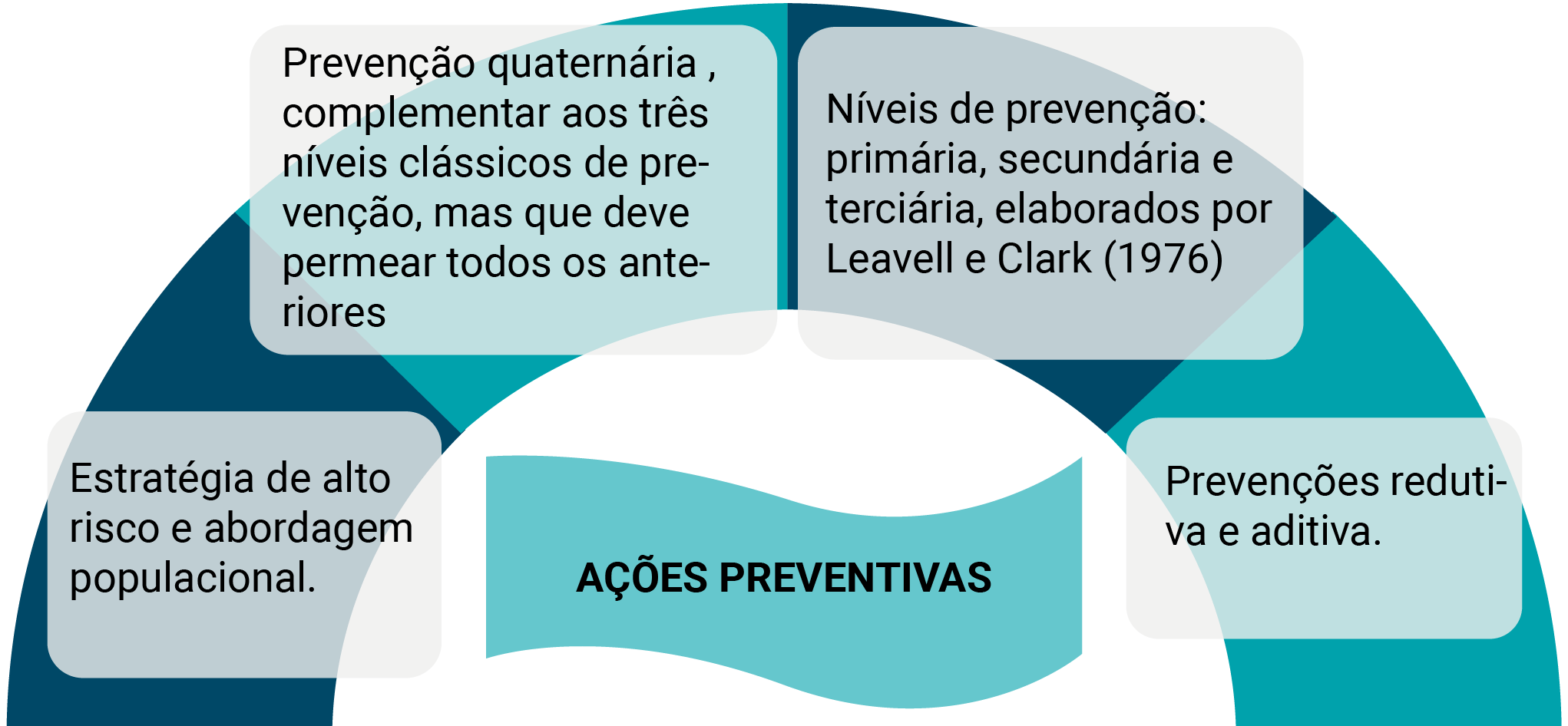
1.2.1 Prevenção primária, secundária, terciária e quaternária (P4)
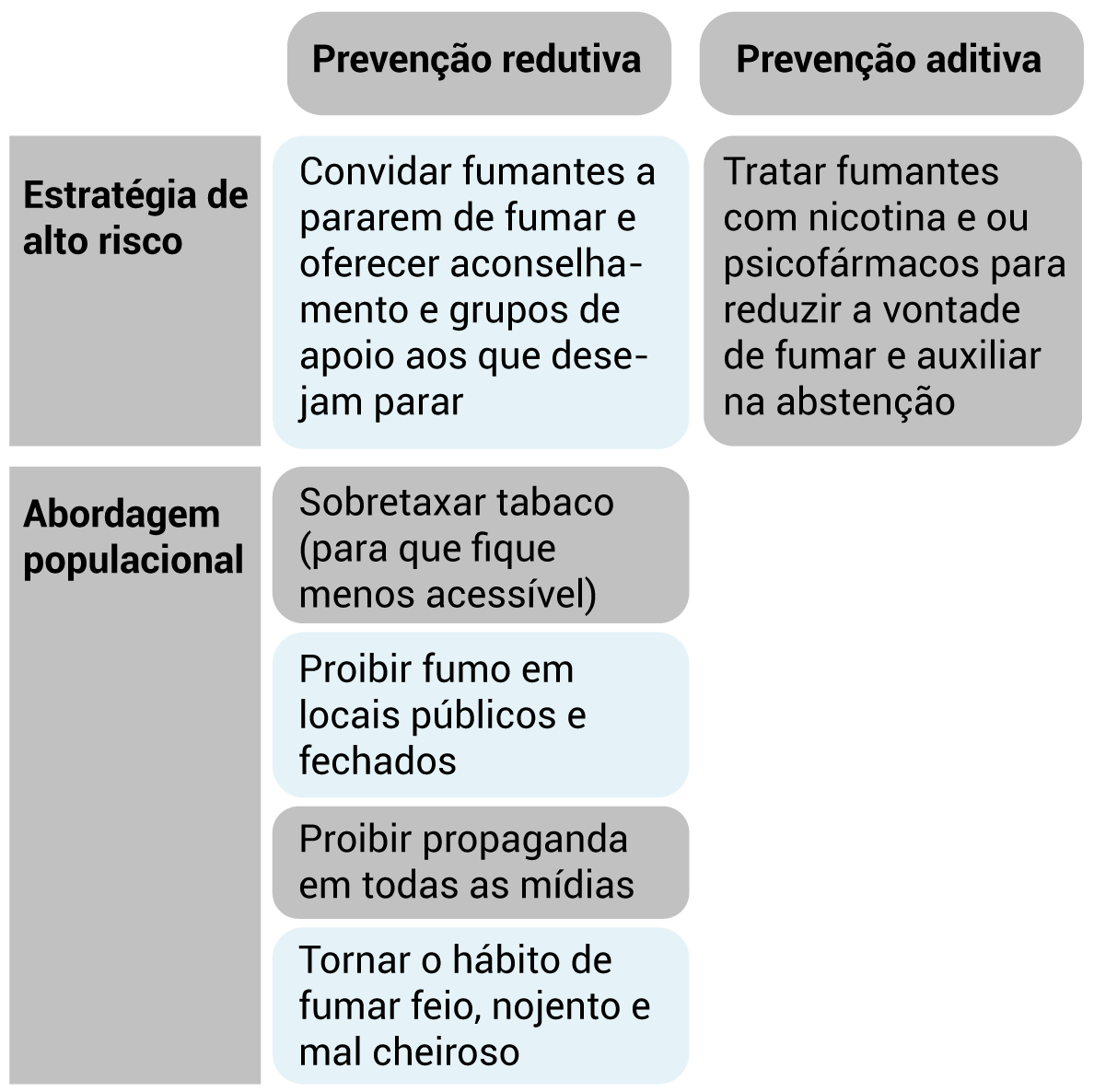
1.2.2 Prevenção redutiva e aditiva
1.2.3 Estratégias preventivas de alto risco e de abordagem populacional
1.3 Importância da P4 na recomendação dos rastreamentos
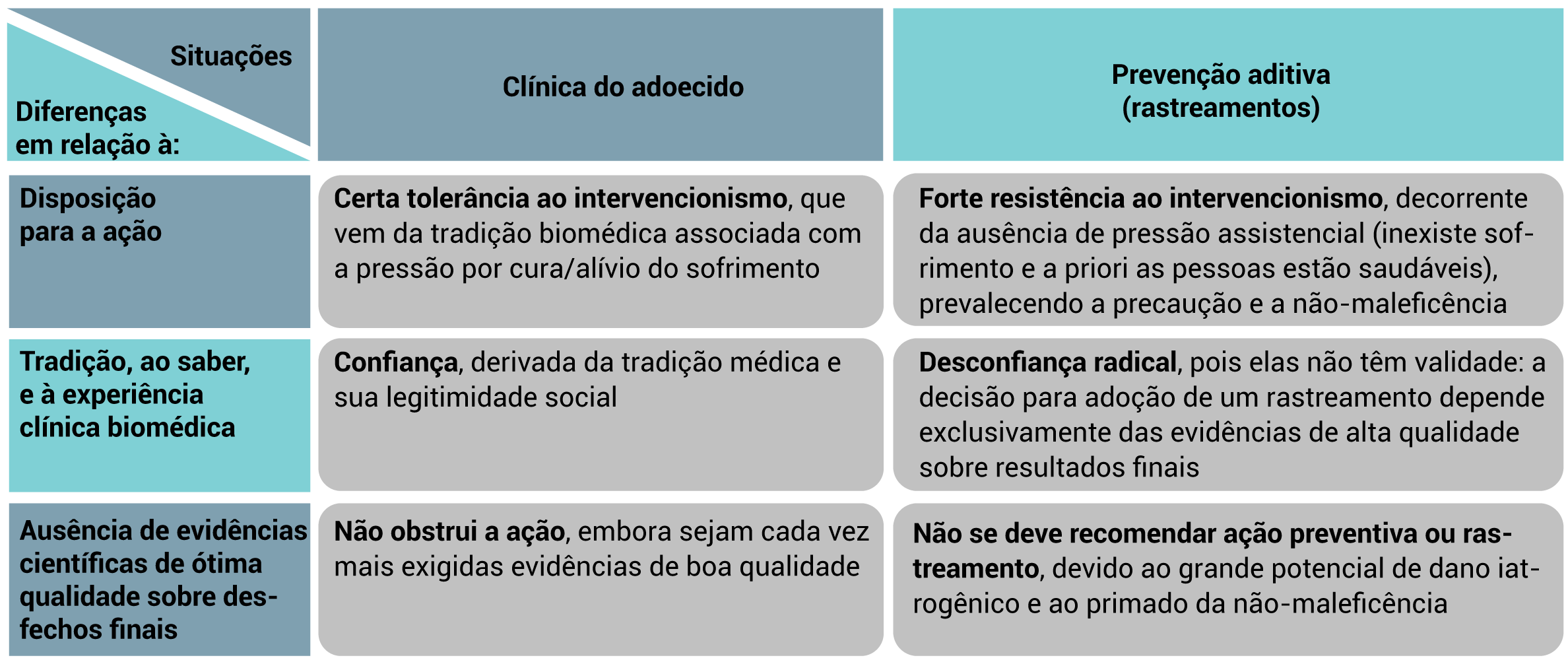
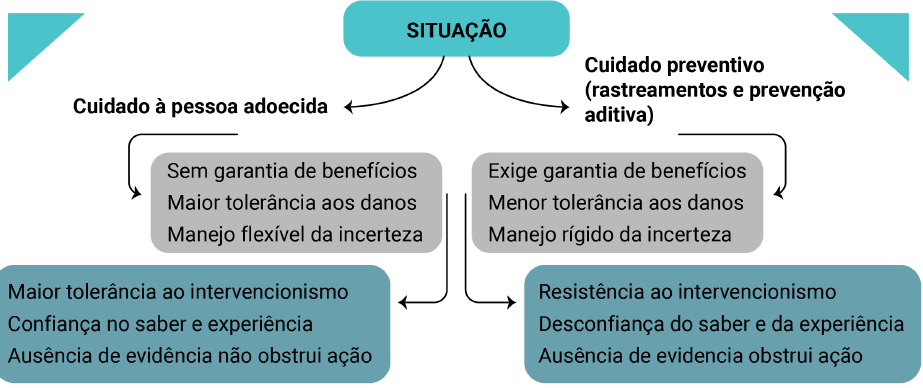
1.3.1 Diferenças entre prevenção (incluindo rastreamentos) e cuidado clínico aos adoecidos
1.3.2 Consequências atitudinais para com os rastreamentos
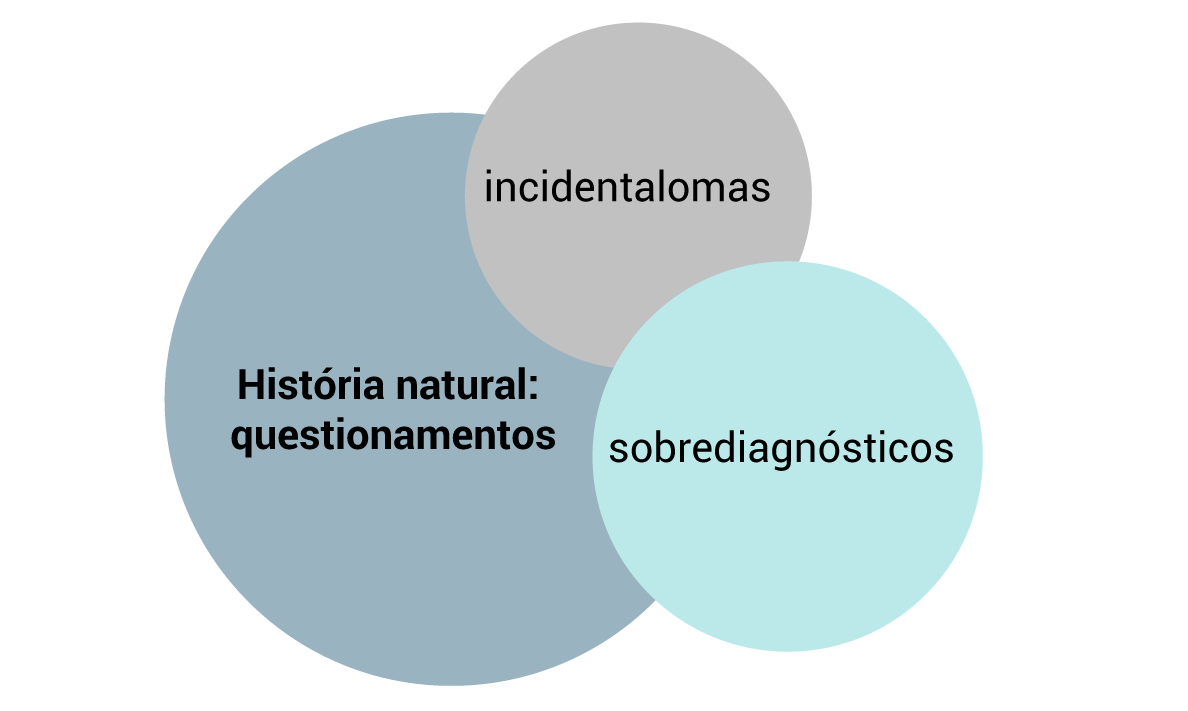
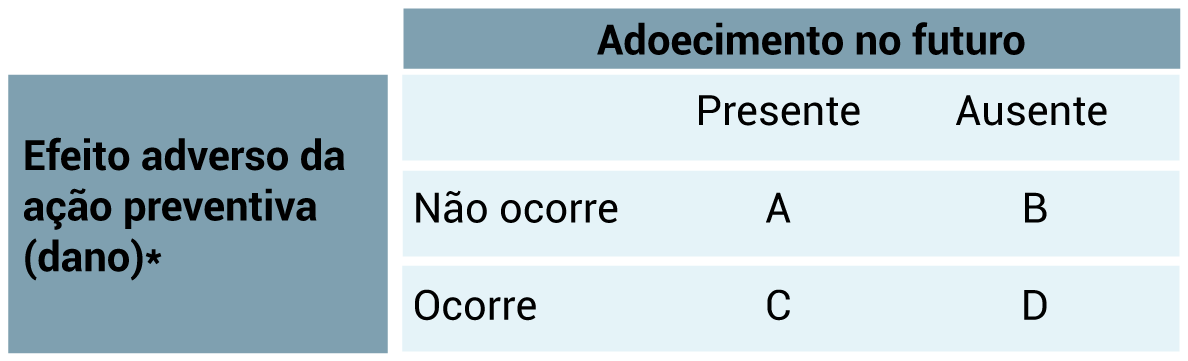
1.3.3 Para entender os danos iatrogêncios dos rastreamentos
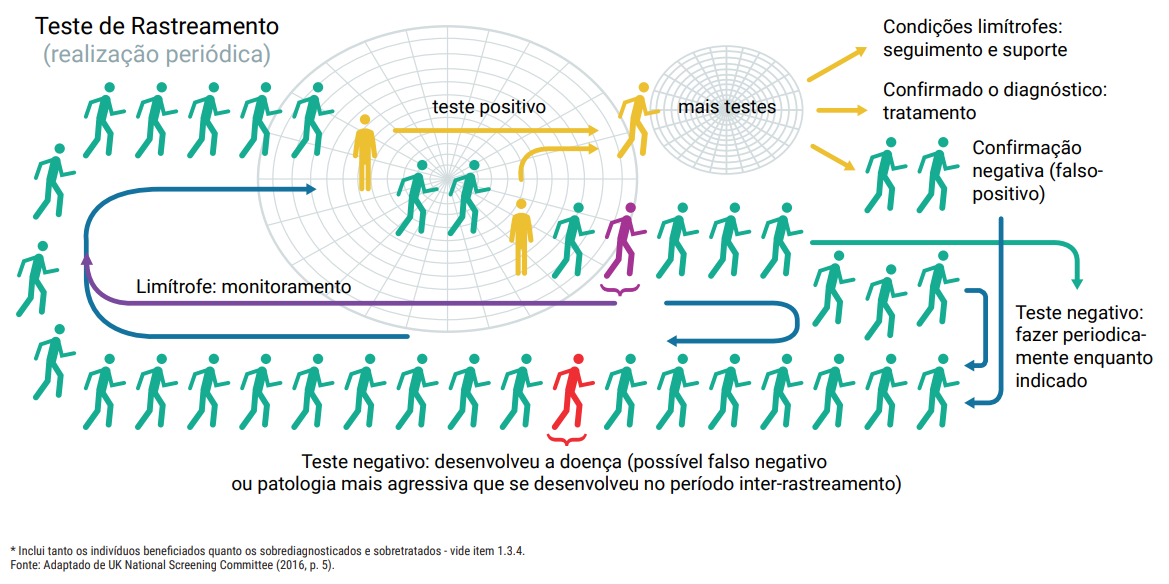
1.3.4 Vieses dos rastreamentos
1.4 Considerações finais: síntese para a abordagem dos rastreamentos na APS
1.5 Resumo da unidade
1.6 Recomendação de leituras complementares

Esta unidade apresenta e discute aspectos essenciais dos rastreamentos ou screenings, também conhecidos como check-ups, uma forma de prevenção cada vez mais utilizada na atenção primária à saúde (APS). A existência de algumas diretrizes oficiais que mencionam a prevenção como prioritária nesse ambiente de saúde tende a construir uma cultura acrítica que supervaloriza ações e cuidados preventivos. Entretanto, nesta unidade você vai entender que os rastreamentos são uma forma particularmente problemática e complexa de ação preventiva que exige muito cuidado na sua recomendação, tanto por parte dos gestores do sistema como dos profissionais da APS.
Embora os rastreamentos tenham o potencial de produzir benefícios às pessoas e à coletividade – e pareçam ser simples de implementar, devido ao aspecto protocolar de suas recomendações – a maioria deles tende a produzir danos.